
 点此咨询
点此咨询
蛋白质在生物体内被誉为“生命机器”,其在转录、翻译、信号传导和细胞周期调控等几乎所有生命活动过程中都发挥着至关重要的作用。天然蛋白质以经济而严谨的方式编码其氨基酸序列,并自发折叠成特定的三维结构,从而实现其生物活性。
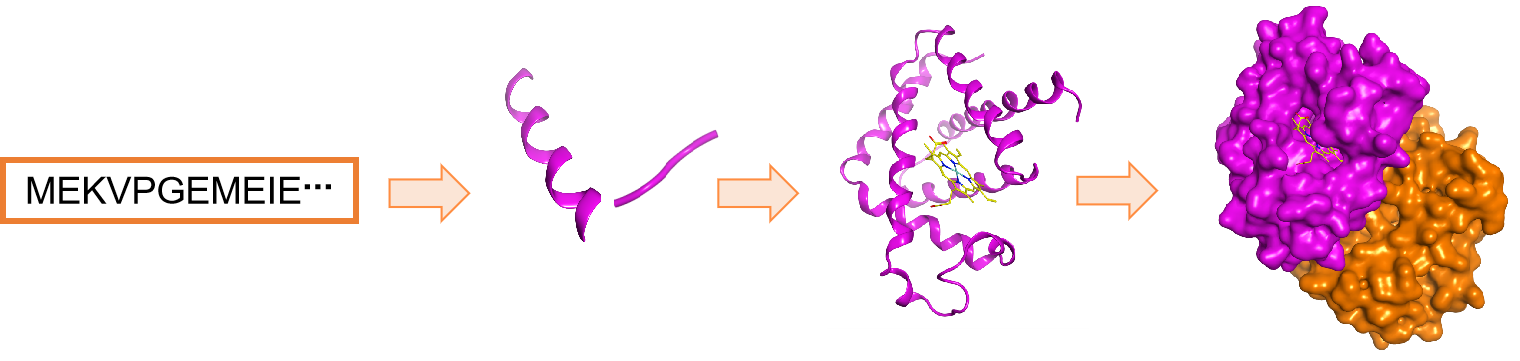
图1 蛋白的一级结构到四级结构
随着对蛋白质功能研究的深入和应用的拓展,天然蛋白质已经无法满足人类日益增长的需求。对蛋白质的改造和设计也从依赖天然蛋白的随机突变和定向进化,向理性设计甚至是从头设计(de novo design)全新的具有特定功能的蛋白质转变。这种设计范式的转变意味着我们可以不仅仅依赖于自然选择的过程,而是通过精确控制氨基酸序列和三维结构来实现特定功能的蛋白质设计。
蛋白质的活性和结构功能由其氨基酸序列的排列方式决定。以一个长度为100个氨基酸的蛋白质为例,其可能的氨基酸序列组合高达20100种之多。在如此广泛的序列空间内进行氨基酸序列的优化搜索面临着极大的挑战。
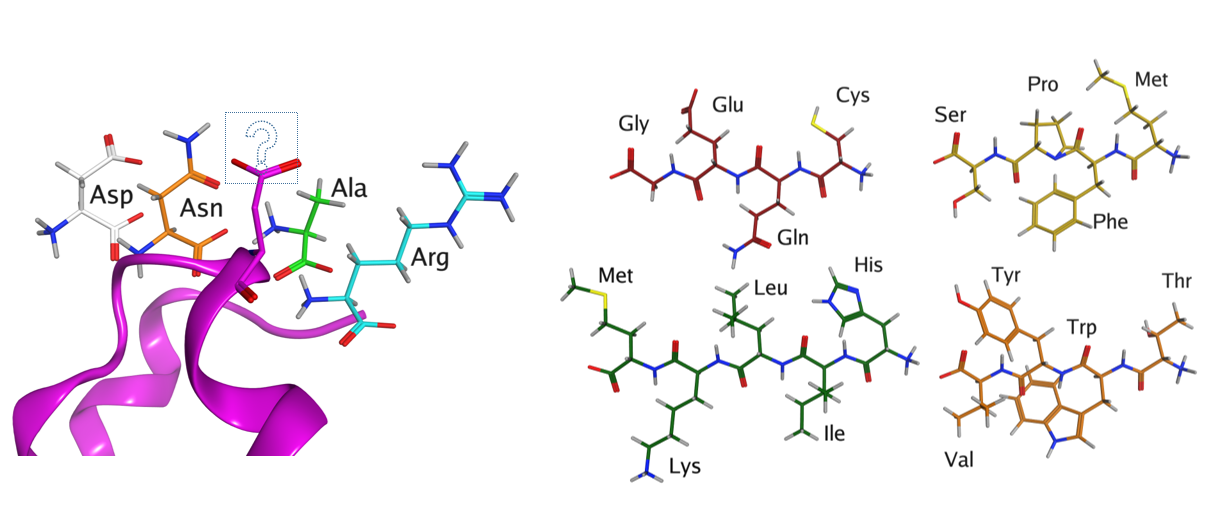
图2 蛋白的氨基酸突变及可选择的氨基酸
蛋白计算设计通过避免相对随机的突变策略,提供了基于蛋白质的生物物理和生物化学原理的指导性设计方案。其目标是设计出一个能够折叠成预定义结构且具有所需功能的氨基酸序列。通常,这种设计会以已知的蛋白质结构为起点,保留活性位点,并对部分序列进行修改,以提高所设计蛋白质的稳定性或实现新的功能。

图3 EvoDesign/EvoEF2模型
传统方法是基于能量函数和启发式采样方法的算法。RosettaDesign、FoldX、EvoDesign/EvoEF2等设计方法使用使用蛋白质结构参数化的打分项来量化氨基酸序列和特定三维结构之间的匹配度,其中RosettaDesign是使用最为广泛的方法之一。RosettaDesign 采用能量函数来捕捉序列-结构关系,对结构中每个残基侧链的氨基酸种类和构象进行采样,并使用蒙特卡洛模拟退火等方法进行优化以获得低能序列和构象。

图4 自研蛋白结构生成模型和序列设计模型
陶术和合作伙伴研发出蛋白结构生成模型和序列设计模型。通过设计可以改变蛋白的物理性质,比如:热稳定性(thermal stability)、溶解度(solubility);也可以通过蛋白设计调整蛋白的生理活性,比如:降低/增加酶活;也可以通过蛋白设计影响蛋白蛋白之间的相互作用,比如:降低/增加蛋白蛋白之间的亲合力,也可以设计新的蛋白/多肽抑制剂或者激动剂。
如果有蛋白设计、多肽设计、抗体设计等需求,欢迎咨询陶术生物!!!