
 点此咨询
点此咨询
“有结合才会有功能,有功能一定有结合”。Binding(结合)和Function(功能)是体外药效初步评价中重要两环,对于候选药物来说,结合是其药物发挥功能的必要条件。基于SPR 技术开发的Biacore 实验,可以非常灵敏的实时监测两个分子之间的结合/互作,且可进行高通量筛选操作。作为新型的生物传感分析技术,SPR实验贯穿于新药研发的每一个阶段,如药物靶点发现、药物筛选、蛋白质组学、免疫原性、生物药研发和生产以及生命科学研究等阶段。
陶术生物提供多种体外评价小分子药物与靶标蛋白结合的技术服务,包括SPR(表面等离子体共振技术)、MST(微量热泳动技术)、BLI(生物膜干涉技术)、ITC(等温滴定量热法)、DSF(差示扫描荧光法)等。
表面等离子体共振技术(SPR)
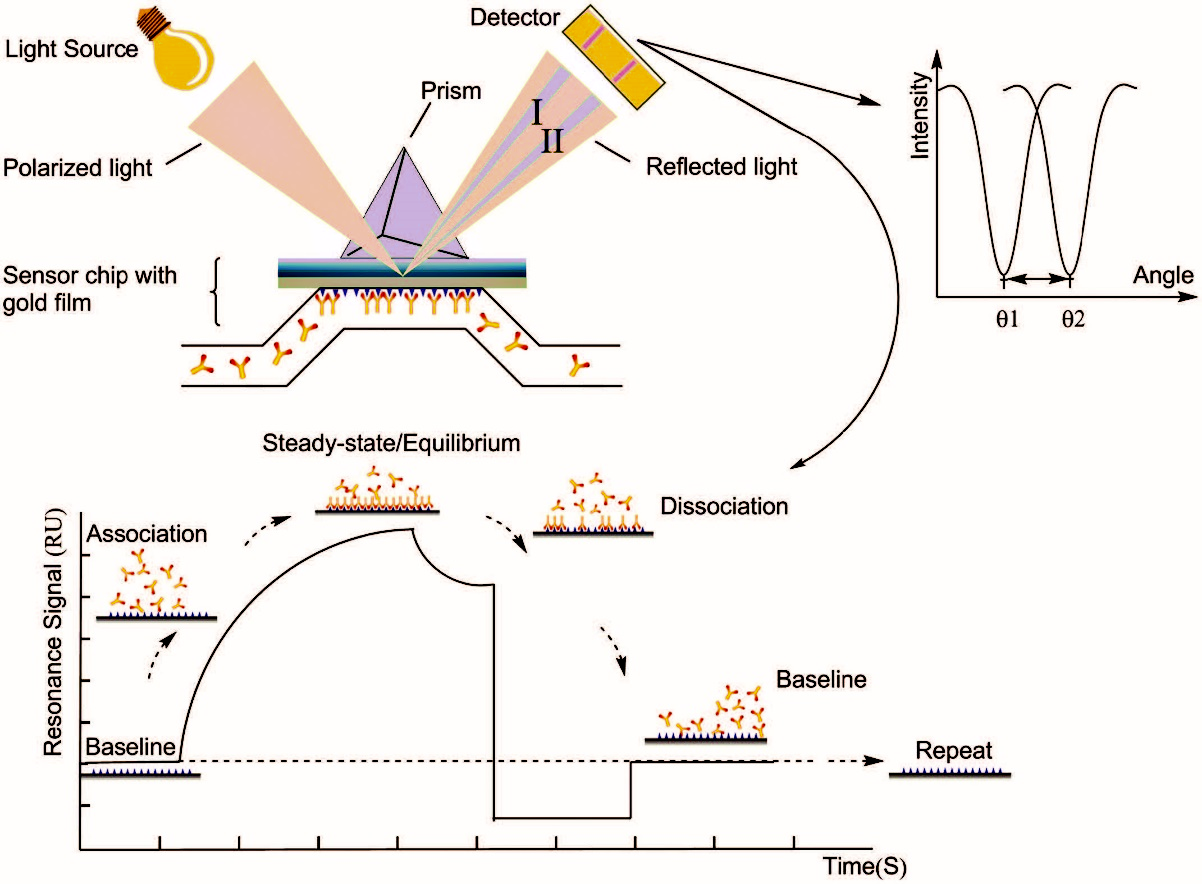
检测原理:表面等离子体共振(Surface Plasmon Resonance,SPR)是一种光学物理现象,这种现象可以由光子或电子诱导。光从光密介质射入光疏介质发生全反射现象,会形成消逝波进入光疏介质。引起表面等离子体共振的入射角称为SPR角。SPR现象与金属表面的折射率相关。当有分析物结合到芯片表面后,导致了芯片表面折射率的改变,从而引起SPR角度变化, SPR生物传感器即检测SPR角的变化,实时监测分子间相互作用。实验时先将一种生物分子固定在传感器芯片表面,将与之相互作用的分子溶于溶液流过芯片表面。检测器能跟踪检测溶液中的分子与芯片表面分子的结合、解离整个过程的变化。
微量热泳动(MST)
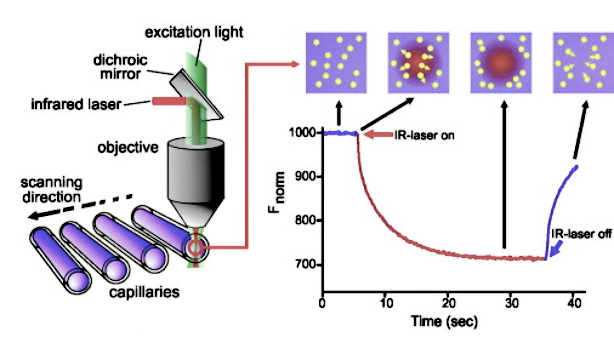
检测原理:微量热泳动(microscale thermophoresis,MST)是一种分析生物分子相互作用的技术。这项技术基于生物分子的热泳动,nanotemper微量热泳动仪使用红外激光进行局部加热导致分子定向移动,继而通过荧光分析温度梯度场中的分子分布比。MST技术能够检测到由于结合而引起的生物分子的大小、电荷和水化层的变化。MST 仪器通过记录激光器打开前、打开期间和打开后处于温度梯度中的样品内部红外激光照射区域的荧光变化情况,从而实现较短时间的测定。
生物膜干涉技术(BLI)
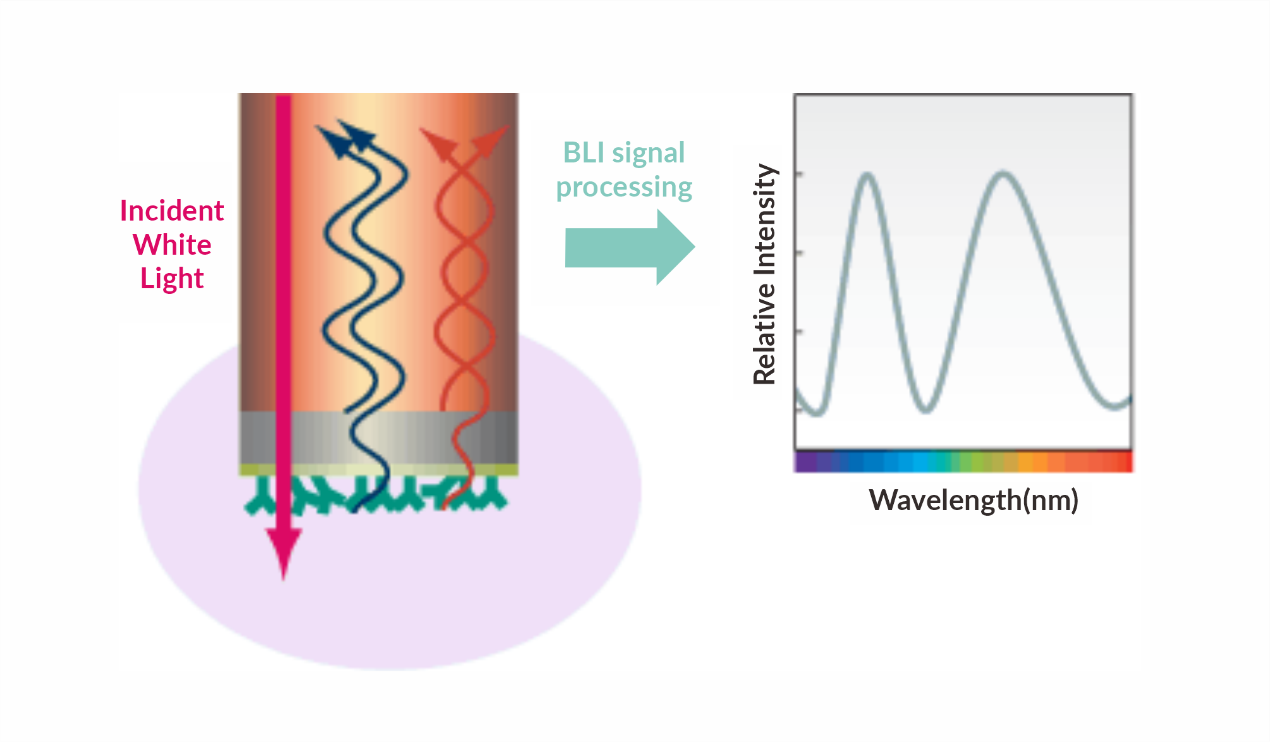
实验原理:生物膜干涉技术(Biolayer Interferometry,BLI)即一种通过检测干涉光谱的位移变化来检测传感器表面反应的技术;当一束可见光从光谱仪射出后,在传感器末端的光学膜层的两个界面会形成两束反射光谱,并形成一束干涉光谱。任何由于分子结合或解离而形成的膜层厚度和密度变化,能够通过干涉光谱的位移值而体现,并通过这个位移值做出实时的反应监测图谱。在 BLI 实验中,一个分子被固定在浸读式传感器表面,检测另一个可结合的分子,分子间的结合导致传感器产生干涉位移,通过实时监测位移变化,从而得到结合曲线。无需标记,可以实时定量测试,检测结果准确、客观、可信。
等温滴定量热法(ITC)
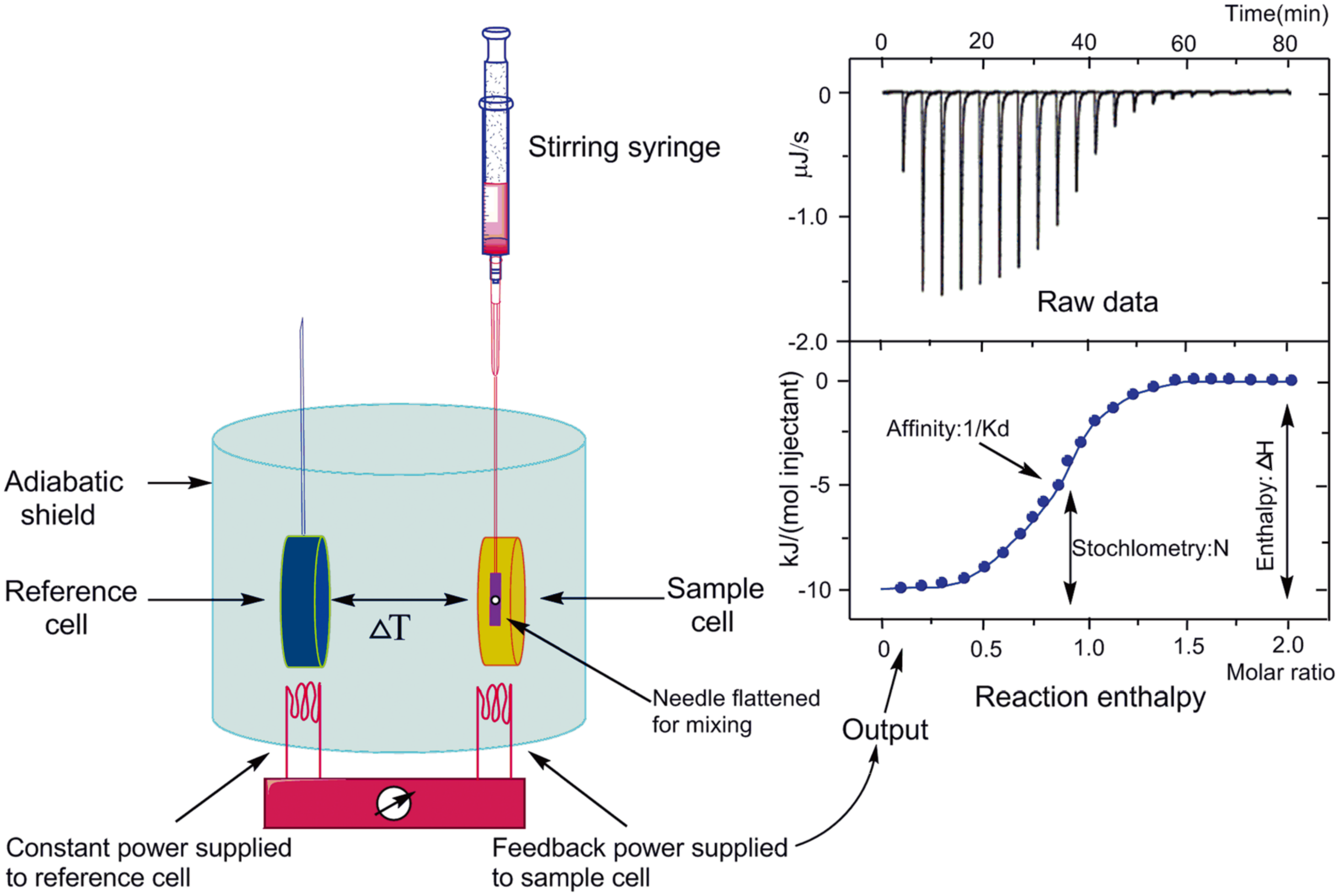
检测原理:等温滴定量热法 (Isothermal Titration Calorimetry,ITC) 是用于量化研究各种生物分子相互作用的一种技术,它可直接测量生物分子结合过程中释放或吸收的热量。通过测量结合过程中的热传递,就能够准确地确定结合常数 (KD)、反应化学量 (n)、焓 (ΔH) 和熵 (ΔS)。仪器包含一个参照池和一个样品池。在实验过程中,配体被可控地滴入样品池中(同时伴随充分混合),每次滴定会产生一个热量脉冲,通过对每一次滴定时热量的积分并对浓度进行归一化处理后生成摩尔放热量(kcal/mol),对摩尔比率(配体/样品)作图,再选择拟合合适的结合模型(Binding Models),获取结合相关的亲和力 (KD)、化学结合计量比 (n)、焓变 (ΔH) 和熵变 (ΔS)。
差示荧光扫描法(DSF)
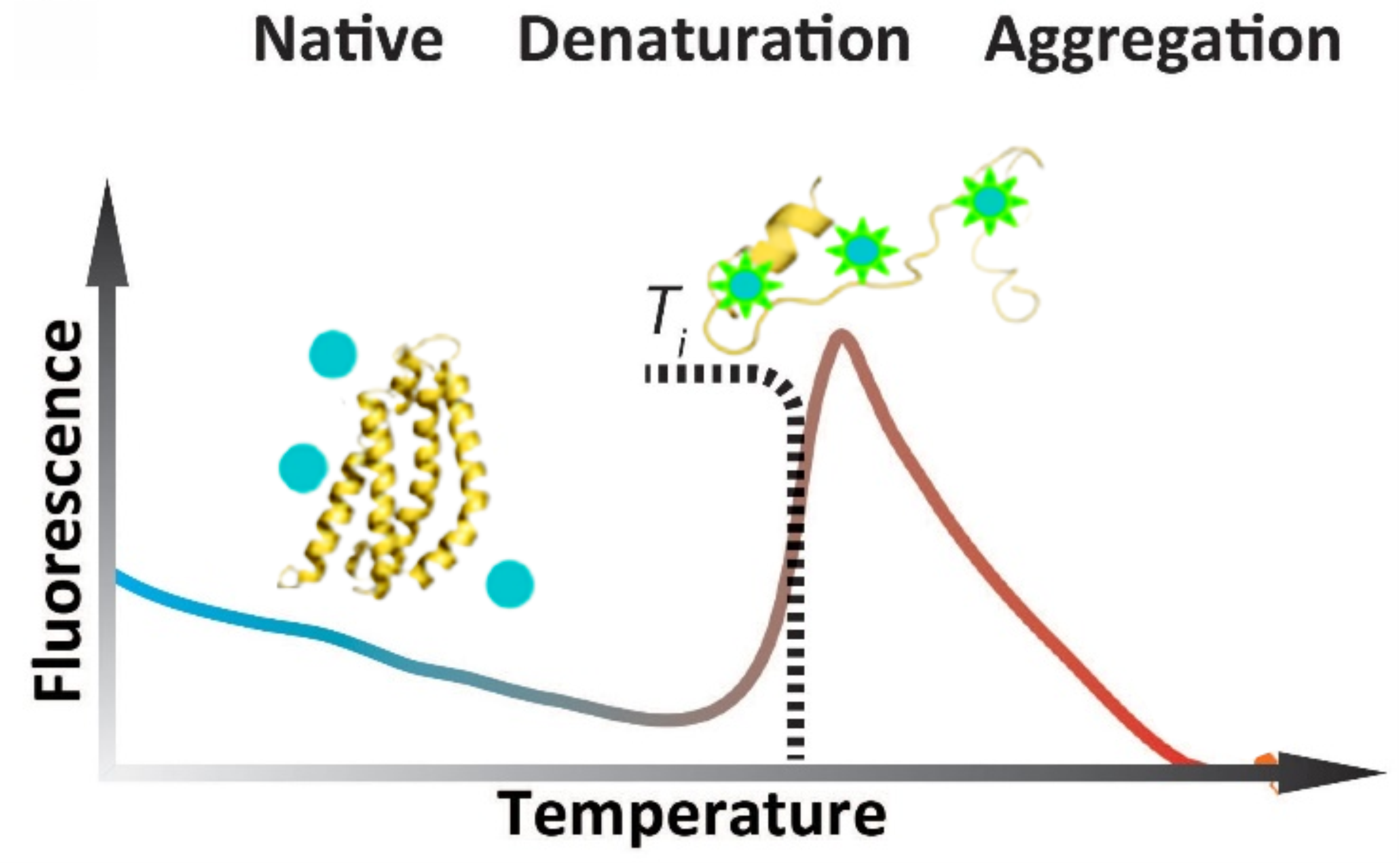
检测原理:蛋白中的色氨酸和酪氨酸的荧光与其所处的环境密切相关。免标记的nanoDSF技术可以准确检测蛋白热变性和化学变性过程中内源荧光的变化。通过检测蛋白内源荧光的变化来跟踪其折叠状态,荧光信号的比值会随温度的增加或化学变性剂浓度的增加而变化,从而测定蛋白稳定性参数Tm值,实现在非标记环境下检测蛋白的热稳定性或化学稳定性。
适用范围
优势特点
技术服务流程
| 客户提供 | 靶点蛋白(>50ug;纯度>90%) |
| 阳性化合物 | |
| 待测化合物/蛋白 | |
| 实验流程 | 模型构建 |
| 分析物测试 | |
| 撰写实验报告 | |
| 服务周期 | 2-3个工作周 |
| 交付结果 | 亲和力测定报告 |
| (包括解离常数Kd、结合常数Ka、解离平衡常数KD) |
样品提供
客户只需要提供待测化合物,每个2-3mg,我们会安排相应的筛选和检测服务,最终提供专业的检测分析报告。
询价及订购
感谢您选择我公司的技术服务。如有任何相关的问题,请您联系我们的工作人员,我们即刻为您解答和服务。