
 点此咨询
点此咨询
分子动力学是基于经典力学的一种分子模拟方法。与分子力学不同,分子动力学求解的是随时间变化的分子的状态、行为和过程。该方法模拟分子运动的过程,它按照分子瞬时的运动状态,求解每一个原子的牛顿运动方程和每一个原子的位置和速度,并从这一运动轨迹中计算得到各种性质。如果在所研究的模拟时间内能正确地选取分子体系的力场函数形式及其参数,分子动力学就可成为解析分子运动性质的一种强大工具。
蛋白质的结构和功能密切相关,蛋白质不同的构象对应不同的生物功能、所有的生物大分子在生理状态下都是动态的,蛋白质是动态的存在和发挥功能的,生物体内的一系列生物事件的发生是依靠蛋白质的动态构象变化来调节的,药物与蛋白结合或离解的过程也是动态变化的。蛋白质的构象变化,小到局部的残基侧链的位置变化,大到整个结构域的运动,时间尺度从飞秒(fs)到毫秒(ms)甚至秒(s)有很大的波动范围。研究蛋白质的动态性质,对进一步认识蛋白质的结构功能关系和通过结构功能关系知识进一步了解和控制生命过程具有重大意义。
研究蛋白质的动态性质通常采用两种模拟方法;分子动力学模拟方法和构象空间搜寻方法。分子动力学模拟是20世纪80年代在分子力学的基础上发展的运用牛顿力学规律研究分子体系随时间演化的动态构象变化的一种模拟方法。分子力学存在着容易陷入初始构象附近局部低能构象的缺陷,且不能研究化学或生物体系的动态行为,而要寻求更多的局部低能构象或全局低能构象可采用分子动力学模拟方法。如果模拟时间足够长、取样足够充分,模拟轨迹的结果也可以统计地用来描述分子体系的热力学性质。构象空间搜寻方法是搜寻全局能量最小值的一种方法,如蒙特卡洛(Monte Carlo)方法,它通过随机地探测构象来确定分子体系的能量分布,但不研究时间演化的动态构象变化。
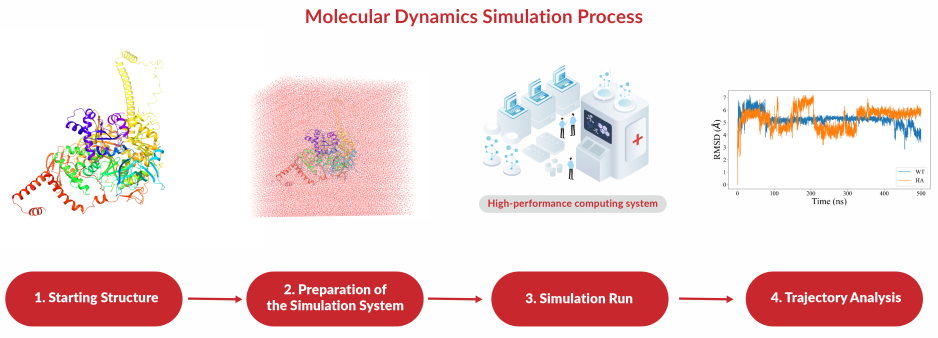
分子动力学将原子看作是一连串的弹性球,原子在某一时刻由于运动而发生坐标变化。在运动的任一瞬间,通过计算每个原子上的作用力和加速度,来测定它们的位置和运动速度。由于一个原子的位置相对于其他原子的位置不断变化着,同时力也在变化,可用适当的力场方法通过评价体系的能量,计算出任一特定原子的力。分子动力学模拟可作瞬时的,通常为皮秒(10- 12s)级的分析,由此模拟计算而获得以一定位置和速度存在的原子的运动轨迹。
使用分子动力学方法可以获得分子体系的各种构象,进一步根据统计力学求得体系的各种热力学性质,如焙、嫡、热容和自由能等。其中吉布斯自由能是非常重要的概念,从自由能数据可以判断不同状态下体系的稳定性和描述分子间的相互作用。自由能这一指标被广泛引入分子模拟研究中,可以计算药物与受体相互作用时的亲和性和溶剂效应等。由药物与生物大分子的活性是通过与受体生物大分子的相互作用表现出来的,药物与受体的结合自由能与药物的活性直接相关。在自由能计算中,重要的是得到两个状态之间的自由能差。使用自由能微扰方法(free energy perturbation,FEP)可以计算得到自由能差。
我们的优势
1、 有强大的计算资源,可以计算ms级别的时长。
2、 多年的经验积累,能够精准的算出体系的性质,并合理性分析。
3、 提供全面的报告及后续解读。